ブログ
BLOG
こんにちは。究進塾 編集部です。
川崎医科大学附属高校の入試対策シリーズの3回目です。今回は、平成31年一般入試の「理科」第4問の解説をします。
第4問の内容
第4問は化学の分野で、熱分解、酸化・還元を取り扱った問題になっています。
非常に長い問題で、実験が3つ行われているのですが、問題構成を見ていくと、実験1、実験2、実験3が独立した問題になっているので、1つずつ分けて見ていきましょう。
ちなみに原文はこちら↓

問題
【実験 1】にかかわる解答
【実験1】に関する問題は、問(1)~(3)まであります。
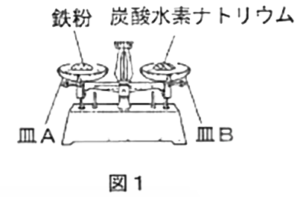
| 【実験 1】図1のように、鉄粉と炭酸水素ナトリウムをてんびんがつり合うようにはかり取った。その鉄粉と炭酸水素ナトリウムをそれぞれバーナーで一定時間加熱し、冷却した後、再びてんびんにのせた。
|
(1) 【実験 1】について、炭酸水素ナトリウムの化学式を答えなさい。
これは知ってないと答えられない問題です。答えは「\(NaHCO_3\)」なのですが、実は炭酸水素ナトリウムはよく出題されるので、この化学式はしっかり覚えておきましょう。
A. \(NaHCO_3\)
| ポイント:炭酸水素ナトリウムは、よく出題されるので、化学式は覚えておこう |
(2)【実験 1】について、炭酸水素ナトリウムを加熱したときに生じる物質の名称を3つ答えなさい。
炭酸水素ナトリウムというのは、加熱すると分解します。では何と何に分解するんですか?というと、二酸化炭素、水、炭酸ナトリウム、と3つに分解します。
これもよく出題されるので、覚えておきましょう。化学反応式も書けるようになっておくとベターです。
A. 二酸化炭素、水、炭酸ナトリウム
| 補足:それぞれの化学式
炭酸水素ナトリウム→炭酸ナトリウム+水+二酸化炭素 |
(3)【実験 1】について、実験結果として最も適するものを、次の(ア)~(エ)から1つ選び、記号で答えなさい。
| (ア) 質量保存の法則により、てんびんはつり合ったままである。 (イ) 鉄粉は加熱によって分解し、皿Aが上がる。 (ウ) 炭酸水素ナトリウムは加熱によって分解し、皿Bが上がる。 (エ) 炭酸水素ナトリウムは加熱によって酸素と化合し、皿Bが下がる。 |
実験結果を選択する問題です。まずこの実験で何が起こったのかと考えてみると、炭酸水素ナトリウムは(1)(2)で見てきたように、熱分解して二酸化炭素・水・炭酸ナトリウムになったわけです。鉄の方は加熱すると空気中の酸素を奪い取って酸化して、酸化鉄になります。
こういうことが起こるっていうことを考えると、まず(ア)は、質量保存の法則により、化学反応前と反応後が等しいのですが、ただし炭酸水素ナトリウムの場合は二酸化炭素が気体なので、これは空気中に飛んでいってしまいます。だから天秤の上には残りません。
水も、加熱すると水蒸気です。
ということは、炭酸水素ナトリウムを加熱すると元より重さが軽くなるわけですね。だから、(ア)は間違ってます。
次に、鉄の方は先ほど説明したように、酸素が結びついて酸化するわけですから分解しません。元々鉄は「単元素」=1つの種類の原子からなっている物質なので、それはこれ以上分解することはないです。だから(イ)も間違いです。
(ウ)が正解なんですが、(エ)を先に見てみると、炭酸水素ナトリウムは加熱によって酸素と化合し、さっき説明した通り、炭酸水素ナトリウムは加熱によって化合はしません。分解します。なので間違っています。
ということで、(ウ)の炭酸水素ナトリウムは加熱によって分解し、皿Bが上がる。上がるっていうことは軽くなるっていうことです。
A. (ウ) 炭酸水素ナトリウムは加熱によって分解し、皿Bが上がる。
| ポイントのまとめ
鉄は熱で酸化して空気中の酸素を取り込むので重くなる |
これで、【実験 1】に関する解答ができました。
【実験 2】にかかわる解答
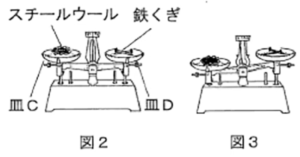
| 【実験 2】図2のように、スチールウールと鉄くぎをてんびんがつり合うようにはかり取った。そのスチールウールと鉄くぎをそれぞれバーナーで一定時間加熱し、冷却した後、再びてんびんにのせると図3のようになった。
(4) 【実験 2】について、同じ金属が同じ化学変化をしているにも関わらず、皿Cが下がった理由を説明しなさい。
|
今度は、スチールウールと鉄くぎを、てんびんが吊り合うように測り取ったとき、スチールウールと鉄くぎを同じように加熱後、冷却しててんびんに乗せるとスチールウールの方が重くなっちゃいました、それはなぜですかという質問です。
スチールウールって、知らない人が結構多いんですが、金属のたわしです。細い金属が繊維状になっていて、いっぱい絡み合ってるものです。

鉄くぎもスチールウールも、主成分は鉄で同じなんです。なので加熱すると酸化するのですが、何が違うのかというと、細い繊維がいっぱい集まってできているので、表面積がむちゃくちゃ大きいわけです。
「酸化する」というのは、物質の表面からしか酸化できません。なぜかと言うと、空気中の酸素とくっつかないと酸化しないので、表面積が圧倒的に大きいスチールウールの方が、より多くの量が酸化されるわけです。
なのでスチールウールの方が重くなる、より多く酸化されるから、ということになります。
A. 鉄くぎに比べて、スチールウールは表面積が非常に大きいので、より多くの鉄が酸化されるため
【実験 3】にかかわる解答
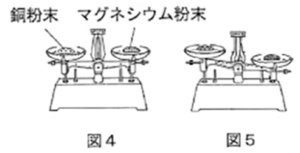
| 【実験 3】図4のように、銅粉末とマグネシウム粉末をてんびんがつり合うようにはかり取った。その銅粉末とマグネシウム粉末をそれぞれバーナーで十分に加熱し、冷却した後、再びてんびんにのせると図5のようになった。
(5) 【実験 3】について、加熱前の銅粉末、マグネシウム粉末の質量はともに1.92g、銅粉末の加熱後に生じた物質の質量は2.4g、マグネシウム粉末の加熱後に生じた物質の質量は3.2gであった。このとき、次の問いに答えなさい。ただし、マグネシウム原子と銅原子は、両方とも酸素原子と1:1の数の比で結合するものとする。 |
こちらは(5)の中に小問が①〜⑧に分かれていて、計算も入っています。1つずつ見ていきますが、問題の中で一番重いところは①です。
まず実験3の文章を読むと、図4のように同量の銅粉末とマグネシウム粉末をそれぞれ加熱して冷却すると、図5のようにマグネシウム粉末の方が重くなりました、ということを言ってます。
そして(5)の文章において、マグネシウム原子と銅原子はそれぞれ
・マグネシウム原子 1個 + 酸素原子 1個 → 酸化マグネシウム
・銅原子 1個 + 酸素原子 1個 → 酸化銅
それぞれ1個ずつがくっついて酸化マグネシウム、酸化銅になる、ということを説明してくれています。
①このとき銅粉末は、加熱した結果として酸化銅に変化している。この化学変化を化学反応式で表しなさい。
「化学反応式を書きなさい」ということなので、銅と酸素から、酸化銅が出るわけですが、これはもう問題文に「銅と酸素が1個ずつ結びつく」とヒントが書いてあります。
なので、生成するのは「CuO」です。これを左辺と右辺で銅のCuの数とOの数が、つじつまが合うように係数を決めてあげればいいわけです。
A. \(2Cu + O_2 → 2CuO\)
| ポイント:銅の酸化の化学反応式は、書けるようになっておこう
銅の酸化については、これもよく出るので「何と何が反応して何ができる」ということは化学式と一緒に覚えておかなければいけないんですが、数については原子の数が合うように決めていくので、必ずしも覚えなくても、そこで計算すれば出てきます。何にしろ正しくかけるようにしておきましょう。 ちなみに、マグネシウムというのは「Mg」という元素記号なのですが同じように1:1なので、マグネシウムの方も酸化すると銅と同じようになり、銅の箇所をマグネシウムに置き換えた反応が起きます。 マグネシウムの化学反応式 → \(2Mg + O_2 → 2MgO\) |
② ①の反応とは逆に、酸化銅から銅を生じさせる化学変化を何というか。
①の反応とは逆に、ということで、これは”右から左”ですね。これは元々酸素がくっついたものから酸素を奪う反応なわけですから、酸化の逆です。このこと「還元反応」と言います。
A. 還元
③ ②の反応を行うために必要な操作を簡単に説明しなさい。ただし、次の薬品群の中から捜査に用いるものを1つだけ選び、説明文に含めること。
| うすい塩酸 うすい水酸化ナトリウム 炭素粉末 硫黄粉末 |
炭素と混ぜてよく加熱する、ということですね。これは何が起こるのかというと、炭素っていうのは非常に酸素と仲がいい元素で、酸素とくっつきたがるんです。なので、元々銅についてた酸素が「私は炭素の方がいいです」と炭素の方に行って、銅の酸素が炭素に奪われるわけです。そうすると酸化銅は還元されて銅になって、炭素は酸化されて二酸化炭素になるわけですが、これは気体なので飛んでいってしまいます。これで純粋な銅ができるということです。
なので炭素が答えになります。
□□炭素は(鉄と比べて)酸素と結合しやすい。
A. 酸化銅と炭素粉末をよく混合して、加熱する。
| あとは時々出るのがアルミニウムで、炭素とかアルミニウムは他の金属に比べて非常に酸素と結合しやすいんですよということは知っておいた方がいいと思います。
ちなみに、これも時々問題になるのですが、鉄工所で鉄の精錬にもこれが使われてます。鉄というのは、鉄鉱石という鉄を多く含んでる石を持ってきて、それから鉄を作るわけですが、鉄鉱石中での鉄は酸化鉄という形で存在しています。これに炭素を混ぜて非常に高温で熱してあげて、酸化鉄の酸素を奪って純粋な鉄を作っているわけです。これが製鉄所の、高炉(背の高い炉)でやられているものです。 |
④ 「てんびん上にある銅原子の数」と「てんびん上にあるマグネシウム原子の数」の大小関係を不等号を用いて表しなさい。
これはまず数字を用いないで、図だけでマグネシウムの方が重くなってるわけです。何で重くなるかというと、酸素がくっついた分だけ重くなっているわけです。ということは、マグネシウムの方がより多くの酸素と結びついたということになります。
ただし、マグネシウムも銅も、
・銅原子1個と酸素原子1個が結びつく
・マグネシウム原子1個と酸素原子1個が結びつく
ということを考えると、マグネシウムの方がより多くの酸素結びついたわけですから、マグネシウム原子の数の方が多い、ということが分かります。
A. マグネシウムの方が重くなったので、鉄より多くの酸素と反応した。よって、「てんびん上にある銅原子の数」<「てんびん上にあるマグネシウム原子の数」
⑤「銅原子1個の質量」と「マグネシウム原子1個の質量」の大小関係を不等号を用いて表しなさい。
元々酸化する前は全く同じ重さがあったわけですね。ところが、④の答えのようにマグネシウムの原子の数の方が多いわけです。そうすると重さが同じわけですから、1個あたりの重さはマグネシウムの方が小さいということになります。
なので不等号で表すと以下のような関係になります。
□□質量が同じで「銅原子の数」<「マグネシウム原子の数」だから
A. 「銅原子1個の質量」>「マグネシウム原子1個の質量」
⑥「マグネシウム原子1個の質量」と「酸素原子1個の質量」の比はいくらか。最も簡単な整数比で答えなさい。
さて、マグネシウムは元々測って1.92gあったわけです。で、それが3.2gになったわけですから、3.2gから1.92を引いたもの = 1.28gが結びついた酸素ということになります。
ということは、マグネシウムと酸素の比は1.92:1.28ということになりますので、これを簡単な整数に直すと3:2ということになります。
□□マグネシウム:酸素 = 1.92g:(3.2g - 1.92g)=1.92g:1.28g = 3:2
A. 3:2
⑦「銅原子 1個の質量」と「マグネシウム原子1個の質量」の比はいくらか。最も簡単な整数比で答えなさい。
マグネシウムと酸素の質量の比は⑥で出しましたので、銅の方も同じように出してあげます。銅は1.92gが2.4gになったので、1.92gの銅は0.48gの酸素とくっついたということが分かります。これを整数比に直すと4:1ということになります。
そうすると、この2つからわかることは、マグネシウムと酸素が3:2、銅と酸素が4:1なわけです。
| 銅 | マグネシウム | 酸素 |
| 3 | 2 | |
| 4 | 1 | |
| 8 | 2 | |
| 8 | 3 | 2 |
小学校の時に、こういう整数の問題をやったことはあると思うんですが、どこかを揃えるわけです。酸素を2に揃えてあげると、4、1というところのマグネシウムが8になります。
これで酸素の2に揃ったわけですが、同じふうに表すと銅とマグネシウムは8:3:2ということになるので、聞かれてる銅とマグネシウムの重さの比は8:3ということになります。
銅:酸素 = 1.92g:(2.4g - 1.92g)= 1.92g:0.48g =4:1
銅:マグネシウム:酸素 = 8:3:2
銅:マグネシウム=8:3
A. 8:3
⑧【実験 3】において、マグネシウム粉末の加熱を途中で止めたとき、その質量をはかると2.24gであった。このとき未反応のマグネシウム粉末は何g残っているか。
今度は1.92 gあったんですがこれが全部酸化したとすると、3.2 - 1.92 なので1.28gの酸素と結合するわけです。だから1.92gのマグネシウムは1.28gの酸素と結合します。今度は2.24gだったので、重さ2.24 - 1.92 となり、結合した酸素は0.32gということになります。
ということは、酸素の量が\(\frac{1}{4}\)しか結合してないので、マグネシウムの方も\(\frac{1}{4}\)しか結合してない、つまり1.92の\(\frac{1}{4}\)で、0.48gのマグネシウムが結合したということが分かります。
で、ここで聞かれてるのは、残ってるマグネシウムの重さ、未反応が聞かれてるわけですから、元々あった量から反応した量を引いた1.44g というのがこの答えになります。
| 反応したマグネシウム (g) | 反応した酸素 (g) |
| 1.92 | 3.2 - 1.92 = 1.28 |
| 0.48 | 2.24 - 1.92 = 0.32 |
□□よって、未反応のマグネシウムは、1.92g - 0.48g =1.44g
A. 1.44g
まとめ
以上、川崎医科大学附属高校 化学 過去問解説「熱分解, 酸化・還元反応」について見てきました。
過去関連記事はこちら↓
川崎医科大学附属高校の入試対策
→【2025年版】川崎医科大学附属高校 数学 過去問解説|小問集合
→【2025年版】川崎医科大学附属高校 物理 過去問解説│力学
→【2025年版】川崎医科大学附属高校 数学 過去問解説│関数(1次,2次)と図形
| 講師:江口和弘
<経歴> 一般企業で研究職として活躍後に、塾講師へ転身しました。大学補習の物理系科目をメインに活躍しています。明るく親身な指導が特長で、これまで何人も単位取得に導いています。 |